Ratings and Reviews of Online Casinos
1. Sol Casino
Free Sign-Up Bonus: 150 Free Spins ( Free Sign-Up Bonus Link )
First Deposit Bonus: 150% up to €/$ 300 ( Registration Link )
2. Fresh Casino
Free Sign-Up Bonus: 60 Free Spins ( Free Sign-Up Bonus Link )
First Deposit Bonus: 100% up to €/$ 1000 ( Registration Link )
3. Jet Casino

Free Sign-Up Bonus: 60 Free Spins ( Free Sign-Up Bonus Link )
First Deposit Bonus: 200% up to €/$ 500 ( Registration Link )
Orkiprenaliinin enantiospaation KäyttaMällä dfdnb -tutkimusleheen perustuvaa hplc- ja Kiraalireagensia
Pp. 1-18
1Hariom nagar* 1Renu Vyas, 2shiv alvera,
1Sarjakoulu Applications, Suresh Gyan Vihar University, Jaipur-302017
2Deple Offiction Ostuctiikka, Intian Luonnontieiden KouluTeksen Ja Tuttkimuksen Instituutti Mohali, Punjab-140306
Sähköposti: [email protected]; [email protected]; [email protected]
Abstrakti
Orkiprenaliini Kohtalaisen Selektiivinen β-Adrenerginen Reseptoriagonisti Ja Sitatka Käytetan Astman Hoidossa. Yleensä β-salpaajien (s)-(̶) -nantiomeerit ovat farmakologisesti tehokkaita, Osoittaavat noin 50–500-kerroisesti Korkeammat aktiivisuudet Kuin Sen (r)-(̶)-nantioneerissä. Orkiprenaliinin diastereomeerit syntetisoiin käyttammasa kiraalista Johdanamalalla yksi fluoriatomi 1,5-difluori-24,4-dinitrobentseenissä KIRALLISESTI PUHTAALLA L-AMAMINOAMAMI; L-fenyylialaniini. Kiraalisen Johdannaisen Reagenssin Karakterisointi Tehtiin Käyttammasa uv-, Ir-, Chn- JA 1H NMR -LaiteTeta. Diaseomeerit SynteTisoitiin MikroaaltosätelytyKsessä 45 S 80%: LLA (800 W) Ja Sekoittamalla myps 50 MINUUTIN AJAN 45 ° C: SSA. LISOKSI DIASTEREOMEERIT EROTETTIIN Korkean Suorituskyvyn Nestekromatografialla Kärnteisessä VAIHEOLOSUHTEESSA C18-PYLVÄLÄ, JONKA HAVITSEMIN 340 NM. Asetonitriilili Ja Vesipitoisia trifluorietikkahappoa (TFA) Käytettiin Liikkkuvina faasikomponentteina. Johdannais- Ja Kromatografinen Erotus olosuhteet Optimoitiin Hyvien Tulosten Saavuttamisesi. MenetelmuN VAMPOINTI TEHTIIN TARKKUUDEN, TARKUUDEN,.
Avensanat Orkiprenaliini, 1,5-difluori-2,4-dinitrobentseeni, enantiopiteetti, Nestekromatografia,
Esitteisesti
Orkiprenaliini (ORC) Kohtalaisen Selektiivinen β2-Adrenerginen Reseptoriagonisti Ja Keuhkoputkenvalvo, Jota Käytetan Astman Hoidossa. Yleensä β-Salpaajien (s)-(-)-enantiomeerit ovat farmakologisesti tehokkaita Kuin Sen (r) -Muoto Ja Osoittaa Noin 50–500-Kertaista Korkeampaa Aktiivisuutta (Lee Ja William 1990). Mutta Useimsa Tapauksissa β-Salpaajia Annetaan Raseemisina Seoksina.
Monet kliiniset farmakologit ja biologit pyrkivät käsittelemään lääkettä isomeerien seoksilla ikään kuin yksi yhdiste olisi mukana ja myös lääkäri, joka esitetään tuotenimellä sellaisella lääkkeellä, ei ole tietoinen isomeereistä ja yleensä hän tekee virheitä (Ariëns 1984). Se JohtuU enimmänseen YHden Enantiomeerin Saaatavuudesta, Kuten Enantiomeerisesti PuhdisteTussa Muodossa. Käytä imimmissa tapuksissa ei -ovotulla enantiomeerillä voi olla sivuvaikutUsia tai jopa myrkyllisiä vaikutuksia. Joten On Ensiarvoisen Tärkeäi Ja Haastavaa, Ettan Lääottoiden Optin PahAus märäretan, Ja JA JE EI OLE Enantiomeerisesti pudasta, Sitten Racomic -seosten Ratkekeminen SEN ERILAISIIN ENANTIONIHIN.
Kirjallisuudessa tällaisten lääkkeiden (β-salpaajien) erottamiseksi on kehitetty ja käytetty kahta lähestymistapaa yksi on suora (mikään minkään tyyppinen enantiomeerien kemiallinen johdannainen) ja toinen on epäsuora lähestymistapa (enantiomeerien johdannaistaminen kiraalisella johdannaisella reagenssilla (CDR) (CDR) kanssa (CDR) (CDR) Kanssa (CDR) (CDR) (CDR) Kanssa (CDR) (CDR) (CDR) Kanssa (CDR). Heidän Diastereomeeriensa Muodostamiseesi) β-Salpaajien enantiomeerisen Erotunksen Saavuttamiseeksi Käytttomälla Korkean Suorituskyvyn Nestekromatografisia (HPLC) TekniKOTA Käyttäräk (HPLC) Tekniiko-. HPLC -TKNIIKOITA KÄYTETTY MYÖS AIKAISEMMIN EPUSUORAN MENETELMÄN AVULLA ERIILAISEN AKTIIVEN LEäKKEIDEN ENANTIOMEERISTEN EROTUSTUNTEN AVULLA; Aminohapot (Bhushan Ja Nagar 2013) Ja Selenometioniini (Bhushan Ja Nagar 2014a) Käytttolallä CDR: ÄÄ, Joka PerustuU (S) -Naprotseeniin Moiety, Isoxsuprine (Bhushan Ja Nagar 2015) Ja Selenometioniini (Nagar Ja Bhushan 2014) Käyttammasa CDR: ÄÄ, Joka PerustuU diflUorilaitteisiiny.
Kirjallisuudessa Tiettyjä Kiraalisia paikallaan olevia vaaheita (CSP) Käyttyny Orc: n enantiomeerien suoran Erotamiseen; Sulfobutyyylieetteri-p-syklodekstriini (SBECD) (ngim et ai. 2012), Metyyli-P-Syklodekstriini (Met-β-CD) (Amini et ai. 2000) JA Sulfatoitu-β-Syklodekstriini (S-P-CD) (Yang et ai. 2005) C18 -Sarakkeena Kiraalisen Valitsimena Suoran Lähestymistavan Avulla HPLC: SSä. L-glutamiinihappoa Käytettiin Kiraalisena indusoivanna Reagenssina (CIR) ORC: N Enantiomeerien (Bhushan Ja Nagar 2015) Ratkaisemiseki Suoralla Lähestymistavalla Ohuessa Kerroksen Kromatografiaass (TLC) (TLC) (TLC).
Yllä oleevan Kirjallisuuden Lisärsi Bhushan Ja Nagar (2014b) SURITETTU ORC: N EnantiopieToinnilla Käytttomällän 1,5-diflUori-2,4-dinitrobentseeniä (dfdnb) -pohja), johdaalisia (dfdnb) -pohja-reasseja (dfdnb) -pohja (dfdnb).
Dfdnb, Nimittain Sangerin Reagenssina, BifunktionAalista Variantti Käytettiin Ensimmus Kertaa Proteiinien, Kuten Villan, Silkin Ja Insuliinin, Ristiyhteydeessä (Zahn Ja Meienhofer 1958). Marfey (1984) Suoritti dfdnb: n Reaktion L-alanii-Amidin Kanssa Ja Muodosti Sen Kiraalisen Variantin, Nimittain 1-Fluori-2,4-dinitrofenyyyli-l-alaninamidi (FDNP-L-ALA-NH2, Marfey-ReaSSI) Yksi Fluoriatomi dfdnb: ssä substitiitiin l-alaniini-amidilla. Täta Kiraalista Johdannaista Reagensia (CDR) Käytettiin VIIDEN DL-AMINOHAPPOJEN HPLC-Enantiopaattiin. Dfdnb-Pohjaisia CDR: ITä Käyetty MyÖs Bhushan-Laboratoriossa β-Salpaajien Erottamiseesi (Bhushan Ja Tanwar 2008; 2009; Bhushan Ja Dixit 2012), Lukuun Ottamatta Orc-, α-Aamino-Aamino-aamino 2008 (Bhushan Ja Kumar 2009a). Marfeyn Reagenssin Käytösta on Ilmestyyt Tiettyjä ArvosteluartKeleita (B’Hymer et ai. 2003; Bhushan Ja Brückner 2004; 2011) CDR: Nä.
DFDNB: n ominaisuuksien vuoksi edellä mainittu kirjallisuus ja siinä mainitut viitteet DFDNB-pohjaisten CDR: ien synteesistä, L-PHE valittiin kiraaliseksi aminohappoksi DFDNB-pohjaisen CDR: n synteesille L-phe osoittaisi resonanssia suoralla konjugaatiolla, para-sijoitettujen-NO2-ryhmän kanssa, Ja Sen Odotetaan Lisäävan Edellen Dinitrobentseeniosan Molaarista absorptiokykyä. Tämin cdr: n kiraalinen apulate sisältaki –ch2c6h5: n tiLaa vieVää hydrofobisena ryhmäää, joka paranta -cdr: n hydrofobisunta -a.
CDR: Ää ÄYTETTIIN ORC -YHDISTEEN NESTEKROMATOGRAFISEEN ENANTIOPAATIOON, KOSKA SEN ENANTIOPIETILISTISTA EI OLE RAPORTTEJA KÄYTOLÄLÄ TÄTÄ DFDNB -POHJAista CDR: ÄÄ. Menetelma Vimititiin Lineaarisuuden, TarKkuuden, Havaitsemisrajan (LOD) Ja KVantifioinnin Rajan (LOQ) Suhteen (loq). Kirjaijoiden Tietsaten Mukan Tärä isimmänen raportti Tämun cdr: n Käyösta orc -yHdistateen enantiopAatioIntiin (fif. 1).
Koe-
Kemikaalit Ja Reagenssit
1,5-difluori-2,4-dinitrobentseeni, l-fenyylianiiniini (l-phe), orciprenaliinisulfaatti alupent-tabletteina (Zydus Healthcare, East Sikkim, Intia) Saatiiin Paikallisilta Markinoilta. Trifluorietikkahappo (TFA), Fosforihappo (H3PO4), Trietyliamiiniini (TEE), NatriumvetyKarbonaatti (NAHCO3) JA Analytyttisen Reagenssi Luokan, Asetonitriilin (Mecn) jatanolin (MeOhIn) analyytniLin (Metansila) -johahylari (Metanolin (MeEndlO) aSetonitriilin. Merck (Mumbai, Intia). Vesipitoinen – TFA (0.1%) Ja Teap (50 mm) Puskurit Valmistettiin Millipore -vedessä.
Lauta
C18 -sarake (promosil, 250 × 4.6 mm I.D -d., 5 μm) Oli Younglinista. HPLC, Joka Koostuu 10 ml: n pumpun pään, rokotuskaasun, acme uv/vis -detenktorista, Younglinin Manuaalisesta InjekTioventiilisti Ja Autochro-3000-käytttöohjelmisto Oli Younglinista (Gyeonggi-do, Korea). UV-1601-Spektrofotometri (Shimadzu), FT-IR-Spektrometri 1600 (Perkin-Elmer, USA), NMR-Spektrometri 500 MHz (Bruker, Saksa), Ph-Mittari-kyberscan 510 (Singapore) Ja Mikroaalto-Moniarvo 3000 (800 W. , Perkin-Elmer, USA) LAITTEITA KÄYTETTIIN MYÖS KOKEELLISIIN TUTKIMUSIIN.
ORC: N Poisto Kaupallisista Tabuteista
Orc Uutettiin Kaupallisesti Saatavissa Oleevista ”Alupent -Tableteista” Paikallisilla Markkinoilla. Uuttamisprosessi suoritettiin Kirjallisuudessa Kuvatun MenetelmuN Mukisesti (Bhushan Ja Nagar 2014b). TUOTTEEN PUHTAUS VAHVISTETTIIN MÄURITTAMÄLLÄ SEN SULAMISPISTEN JA UV -Absorptio (λmax) -Spektrit, Jotka Sopivat KirjallisUusraPorteiHin. YHDISTEEN TALTEENOTO HAVAItIIN JärjestyKesessä 93–95% Kaupallisissa Merkinnöissä Ilmoitietuista Määrsta. PuhdisteTUTUA YHDISTTTETTU Käytettiin Raseemisea Standardina.
VarastroraTaSujen Valmistelu
NAHCO3: N (1 m) Ja HCl (2 m) LiuokSet Valmistettiin PuhdisteTussa vedessä. Rapemisen Orkin Varastoliuos Valmistettiin Liuttamamalla sopiva määyrä 1 m Nahco3: een ja etettiin
Johdannaisreaktiot. Ratkaisut Ja Näytteet Suodatettiin Käytttomällä 0.45 μm suodattimeti. Asetonia Käytettiin LiuottIMena Cdr: N (25 mm) Liuoksien Valmismisttkeen Ja Sitten CDR: Iin Tallennettiin Jäkaapissa 0–4 ° C: Ssa Elleeen Käytttotkaä Käytttökroitkia Varten.
CDR: N Synteesi
Reagenssin Synteettisten Menettelyjen Herkerkyhyyden Vuoksi Suojattiin Valolta. CDR SynteTisoitiin Ottamalla Käytöön Optisesti Puhdas l-phe Korvaamalla yksi fluoriatomi dfdnb: Ssä Kirjallisuudessa Kuvattujen MenetelMäinä Mukaisesti (Bhushan Ja Kumar 2009b). Nää Karakterisoitiin Ja Varastoitiin 4 ° C: SSA. Alla on Edustava Menetely CDR: N Synteesiki. Seuraavat ratkaisut valmistettiin.
- 1 m Nahco3 Tislatumassa vedessä
- 1 m l-phe-liuos (i) ja
- 2 m dfdnb-liuos asetonivesissä (6: 4, Tilavuus/Tilavuus); Sitan Pidettiin 0–4 OC: SSA
CDR: N Synteesi (1-Fluori-2,4-dinitrofenyyliLi-l-fenyylialAniini; fdnp-l-phe): 20 ml (ii) Lisktiin 20 ml: aan (iii)) JatKuVuLoss. ReaktioSeesta Sekoitettiin JatKuvastat 40 ° C: SSA; 1 Tunnin Kuluttua Tuloksena oleva Liuos Pidettiin Huoneenlämpötilassa 10 MINUUTIN AJAN JA SIIHEN LISUTTIIN 40 ML VETTTA. 20 ml: n HCl: n (1 m) Lisäys tuotti Keltaisia kitittane; Ne Sudatettiin Ja Pestiin Kylmyllä Vedellä. Kiteet Kuivattiin dyyneinä p2o5: n yli.
SynteTisoidun CDR: N RaKenne (fdnp-l-phe) esitetty viikunalla. 2 Ja Sen Karakterisointiedotot Ovat Sopusoinnussa Aikaisempien raporttien Kanssa (Bhushan Ja Kumar 2009b).
Diastereomeerien synteesi
ORC: N DIASASTEREOMEERIT FDNP-L-PHE: LLÄ SynteTisoitiin KirjallisUusraportin (Bhushan Ja Nagar 2014b) Mukan Käytttomillä MW-SäilytusST-.
Diastereomeerien Synteesiä Varten Valmistettiin Liuoksia.
- 1 m Nahco3 Tislatumassa vedessä
- 50 mm orc: n liuos (iv), liuttamalla 10.56 mg orcia 1 ml: SSA (IV).
- 25 mm fdnp-l-phe: n Liuos Asetonissa Liuttattamalla 8.73 mg fdnp-l-phe 1 ml Asetonissa; Sitan Pidettiin 0–4 o
Orc: n liuos (kuten (v) yllä (v) yllä) LISättiin fdnp-l-phe: n liuokoseen (kuten (vi) yllä) te fl: ssä putKessaa. Reaktio -olosuhteiden Jälkeen Yritettiin Saada Optimaalinen ReaktioTotto. ORC: N Ja FDNP-L-PHE: N Annettiin Reagoida Eri Suhteissa, Kuten 1: 1, 1: 1.5, 1: 1.7 Ja 1: 2. ReaktioSeoKset Mikroaaltouunissa Säteilytettiin Uunissa 30, 40, 45, 50, 55, 60 ja 70 S Jokaisessa Kolmessa Eri Teho-Asetuksessa, Nimittain 70, 80 Ja 90%. Elillisiä Reaktioseoksen Sarjoja Inkuboitiin 40, 45 JA 50 ° C: SSA Vakiona Sekoittaen 40, 50, 60, 70 JA 80 min (Kussakin Lämpötilassa). Daistereomeerien Synteesikaavio CDR: n ReakTiolla (r/s) -orc Annettu Viikunalla. 2. Muodostuneeet Daistereomeerit Prosessoitiin HPLC -Kokeen Kautta, Saatujen daistereomeerien Kunkkin Parin Piikkien Alueet OTetTiin Diagnoosina Diastereomeerien Muodostumisen JohdaNannaisreakTioiden LOPPUUN SAATTAMISEISSI JANANANAYTTEIT OTOTTETTIIN SAATNAMISEISSI JANANANANANANAREKAYNARNEINEANAMISEISSI JANANANANANANANAREKAYNAREANATEIN SAATHATENE.
10 μl Tuloksena OLLEVAA DAISTEREOMEERILIUOSTA LAIMennettiin 100 μl: KSI MECN: N KANSSA, KAASUT JA SUOJATTU. NYT 20 μl siitak Injektoitiin pylVäänseen Injektorin Kautta.
HPLC
Seuraamisen Seurauksena Kokeiltiin;
Liikkuvava VaiHe 1, Mecn Teap -Puskurilla (10 mm) Lineaarisessa Gradientissa (30 – 80, 30 – 65, 35 – 60, 25 – 60, 25 – 70, 20 – 60, 20 – 70 JA 10 – 90%) 45 Minuuutin juuoksu.
MOBIILI VAIHE 2, MECN TFA -PUSKURILLA (0.1%) Lineaarisessa Gradientissa (30 – 80, 30 – 65, 35 – 60, 25 – 60, 25 – 70, 20 – 60, 20 – 70 JA 10 – 90%) 45 MINUUTINEN JUOKSUSSA.
MOBIILI VAIHE 3, MeOH TFA -PUSKURILLA (0.1%) Lineaarisessa Gradientissa (30 – 80, 30 – 65, 35 – 60, 25 – 60, 25 – 70, 20 – 60, 20 – 70 JA 10 – 90%) 45 MINUUTINEN JUOKSUSSA.
Kromatografiset ajot suoritettiin ja optimoivat olosuhteet VAIHLEELEVAT PUSKURIN POTOISUUDET (TEAP, 5 – 20 mm JA TFA 0.05% – 0.15%), pH (Aluella 2.0 – 5.5) Ja Virtausnopeus (0.5-1.5 ml/min) Liikkaman faasin. Ennen KäytTöä, MatkapuhelinvaaiHeet Suodatettiin 0: N Läpi.45 Um Suodatin Ja Kaasut Sonikaatiolla Ja OHITITAMALLA TYPPI.
TFA: N Pitoisuuden Kasvattaessa 0: STA.05 – 0.10%Havaittiin Erottetelukerrokosen Kasvu. Erootekijä ei Lisäntyynyt Merkittavästi, Kun Sen Pitoisuus Nousi 0: STA.10 – 0.15%. Korkea tfa -pitoisuus sen voimakaan happaman luonteen Vuoksi voisi olla haitallista pylVäälle; sissi 0.10% TFA: Ta Otettiin Optimoiduna Pitoisuidena. Virtausnopeuden Lasku 1: Sta 0: een.5 ml/min Johti retentioajan lisäntymiseen pienellä piikkien laajentumisella, kun taas toisaalta virtausnopeuden Lisäntyminen 1: sta 1: een.5 ml/min Johti retentioajan ja Δt: n vähentympiseen.
Menetelmun validointi
MenetelMä validoitiin Käytttolallä CDR: llä ValmisteTujen Orc: n diastereomeerejä (fdnp-l-phe) ich-Ohjeiden mukaiSti (ICH 1996). Piikkialueet piirrettiin pitoisuukia Vastaan aleeella 20-100 ng ml-1 kalibrointikäyränien ja kaltevuuden ja korrelaatiookertoimien saamiseeki mäyritetti kahythämänä regressioyn.
TuloKset Ja Keskutus
Diastereomeerit
Dfdnb Erittain HyVä Osa Havaitsemisen ja Reaktiivisuudens Suhteen Sen Johdannamen Muodostamisiesi. TÄMÄ JOHTUU NITRORYHMÄN KROMOFORISESTA VAIKUTUTUSESTA DFDNB: SSÄ, MIKÄKA PARANAA MOLAARista Absorptiokykyä, Kun Taas Sen Voimakas Elektronien VETTAYTAA YHYNAKESH (CAMYNEKESH) HELKEMYN (CJAMYN-LANUKEMIHAIKAIHAIHAIHAIHAIHAIHA-LYRYN (KYLYTYN (SAAMYNEKEN), Fdnp-l-phe). LISTAKSI paria Diastereomeerejä HyVää Molaarista absorptiokykyä tuotettiin Korvaamalla Jäljellä oleeva Fluori CDR: SSÄ (FDNP-l-phe) Kiraalisen Analyytyin Kanssa. Parempi saato satiin seuravissa optimoiduissa olosuhteissa: cdr (fdnp-l-phe) ja orc otetaan moolisuhteessa 1.7: 1; Reaktioseoksen LämmittiMinen 45 ° C: SSA Inkubaattorissa 50 MINUUTIN AJAN VAKIONA SEKOITAEN TAVANOMAISTA LÄMIHITESTÄ SAMALLA SEOKSEN SÄTEILY 45 S (80% 800 W: STYS) MIKROAALTOOLOSUSUSUSUSA. Reaktio Lopetettiin Lisäääällä HCl (2 m, 20 μl) Huoneenlämpötilaan Jäähdytyten Jälkeen. ORC: N DIASASTEREOMEERIEN SYNTEESI FDNP-L-PHE: LLÄ SUORITETTIIN MAINITUUSA OPTIMOIDUISA OLOSUHTESASA. 1.7 -KYSYMYS MOLAARIN YLILÄUTAEN. Kaksi MuodostetUa diastereomeeriä ovat typpiä [(r) -l] -Ja [(s) -l] -missä beimimänen kirjain viittaa analyytin (ORC) KokoonPanoon, Kun Taas Toinen Kirjain L-MäärkyLeLon L-KOOKOONO- -Phe).
HPLC
Sidoter resoluutiosta (RS) Ja Erotuskertoimesta (A) Diastereomeerien Erotamiseki Ovat; 11.76 JA 1.12, Vastavaasti. Teräviä piikkikeä havaittiin liikkaman faasin Kanssa gradientti -olosuhteissa, Joissaan. TÄMÄ JOHTUU Alhaisemmasta Dielektrisestat Vakiosta (33 d) Ja Suuremmasta Viskositeetista (0.59 CP 25 ° C: SSA) Meoh: Sta Verrattuna Asetonitriiliin, Jolla Dielektrinen Vakiossa (37.5 d) Ja Viskositeetti (0.343 CP 25 ° C: SSA). Tfa -Puskurilla (Mobiili VAIHE 2) TERÄVÄMPIU PIIKKEJÄ HAVAItIIN VERRATTUNA TEAP -PUSKURILLA Saatuihin (Mobiili VaiHe 1). Siten Liikkun VAIHEEN 2, JOSSA MECN KÄYTTI ORGAANISENA MODIFIKAATTORINA JA 0.10% TFA Puskurina, Gradientin EluuTiolla (30 – 65% Mecn: Sta) 45 MINUUTissa VIRMAUSNopeudella 1.0 ml/min Ja Havaitseminen 340 nm: SSä Todettiin OnnistoNeen Orkin Daistereomeerien Erottamisesi. CDR: Lla Valmistun Orc: N Diastereomeerien Erotaminen (FDNP-l-phe) Annettu viikunalla. 3.
HPLC: SSä Suoritetaaan Huippualueet, Jotka Saatu Vastaville Daistereomeereille Edellä MainittuJen Johdannaisolosuhteiden Kussakin Muutotsessa, Laskettiin JärjestelMäohjelMistolla; Nää Arvot, Jotka Otetu Reaktion LOPPUUN SAATTAMISEN JA Johdannaismahdollisuksien Saanon Mittaamiseeksi. KAHDESSA olosuhteessa syntetisoitie -diastereomeerien karakterisoinnin Ja Kromatografisten Tietojen (Käytttomällä Tavanomaoma Lämmitytta JA MikroaalToSyteilySTO (MWI)).
Vertailu KirjallisUusraporteihin
TÄSSÄ TutKimuksessa Orc: N Johdanenaine Käytttommasa dfdnb-Pohjaista Cdr: ÄÄ (fdnp-l-phe), Jossa l-phe otettiin KäytTöön Kiraalisen apulaisia mwi: n allo VAATII VOKAALISEN APULAISA: 45. Orc: N Diastereomeerit Erotetun resoluutiolla (RS) 11.76, Joka Parempi Verrattuna Kirjallisuudessa ilmoitieTtuun Resoluutioon (Tauluko 1), Josssa Tietyt CSP: t Ja HPLC: SSä Ja Cir: SSä KäyteTytt CDR: T, Joita Käyttan Tlc: SSäti.
Erotusmekanismi
Tietyt KirjallisUusraportit (Marfey 1984; Bhushan et ai. 2009; Fujii et ai. 1997) Selitetty Tiettyjen Aminohappojen Diastereomeerien hplc -erottamesilla, joka on Valmistetu dfdnb -Pohjaisilla CDR: llä, Sekä Selitys Daistereerien Rettinioajan Ja EluuTosekenssin suhteen.
Bhushan Ja Nagar (2014b) Vahvistivat myös dfdnb: llä ValmisteTujen β-Salpajien daistereomeerien EluuUtioSekvensin kokeellisesti JA MYÖS TEOREETTISESTIIAN 09. 02 OHJELMA-JA Hybridi TiheysfunktionAalinen B3LYP 6-31G (D, P) Perustaa, Joka Tuki Kokeellisia Tulsia. Tämun Tynön mekanismi Kirjallisuudenissa (Bhushan Ja Nagar 2014b) Mukainen, Joka on [(r) -L] -Diastereomeeri, Joka Säilyetty VähemMäinä Aika Verrattuna (S) -L] -DIASEONEONEERIIN, JOKAKAIA TAKAAKAA -JOKAKAA -JOKAKAA TAKAAKAA TAKEAKAA TAKEAKAA TAKAKA.
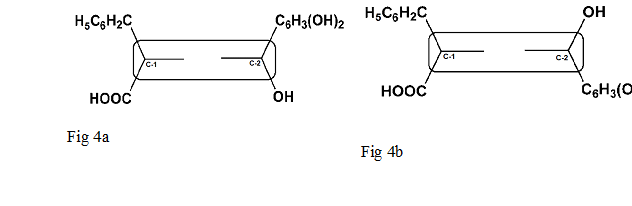
Näiden -diastereomeerien graafinen esilaisuus Esitetty viikunalla. 4a ja 4b. Kuva. 4a, [(s) -l] -diastereomeerissä, hydrofobisiat ryhmät –ch2c6h5 cdr: n stereogeenisessä Keskuksessa (C-1) (fdnp-l-phe) JA –C6H3 (OH) 2 stereogeenisessä Keskuksessa (C-2) ORC: N (Suorakulmiossa) SUUNNATTU SAMALLA PUOLELLELLA DINITROBENTESEANSAN (SUORAKULMION) TASON SUHTEEN JA NIIDEN KATSOTAAN OLLEVAN CIS TOISIAAN KOHTAAN. Kuva.4b, [(r) -l] -diastereomeerissä, –ch2c6h5 ja –c6h3 (oH) 2 -ryhmä Suunnattu avaruteenia Vastapäätto dinitrobentseeniosan Tasoa ja siten niill trans -typpinen.
Toiinin Sanoen [(S) -L] -diastereomeerissä, Jollan cis-typpinen Järjesty (Kuvio 4A), Mikä JohtuU Suuremmasta HydrofobisUudesta, Vuoorova-measia-measessa kansuy-mean-measia-measessa cuoramamin c18-pylven jespyy kansuy cuori-mean-measessa c.-mean. Vähemmun hydrofobisuutta, sissi [(s) -l] -diastereomerillä Pidempi Säilytysaika. Näiden daistereomeerien erilaisten hydrofobisten lUonteen Lisärsi liikkan Vastuusa myös [(r) -l] -l] -l- JA [(s) -l] -diastereomeerien erilaisista retentioekaekaeKoKoaeKoekaeKoKoKoKoKoKoKoKoKOIKAIKAIKAIKAIKAIKAIKAIKAIKAIAIKAIKAIKAIKAIKAIKAIKAIKAIKAIKAIKAIKAIKAIKAEKA. Sissi diastereomeerit eluoivat peräkkkäin näiden erilaishen fysikaalisten.
Nykyisen Tyhön Edut/Uutuus
Diaseomeerien Synteesiin Ja Korkeamman RS: N (Diastereomeerien Erotamisen) Edut On Kuvattu vähemmun Reaktioajan Suhteen “Vertailu KirjallisUusraporteihin”. Kehitetyllä CDR: llä (fdnp-l-phe) Korkeat molaariset absorptioominaisuudet Ja Kyvyn Havaita Diastereomeerit Alhaisella Rajoilla; Havaitsemisraja Todettiin oleevan HyVä (20–11 pg ML-1) ORC: N Diastereomeereille.
Menetelmun validointi
MenetelMäni VaittamiTutkimukset Suoritettiin Käyttammasa CDR: llä (fdnp-l-phe) ValmisteTujen (R, S) -Orc: N Diastereomeerejä (fdnp-l-phe).
Lineaarisuus
(R): N (Ensimmus ElUoiva Diastereomeeri) Ja (S)-(TOinen ElUoiva Diastereomeeri) Diastereomeerien Huippupinta-Alue (y-akseli) CDR: llä Valmistettiin Cdr: ä tai valmistetua Vasta-KonsentraATIOTA VASTAAN (20-100 NGAAVA-1 ; x-islilla). Lineaarisen regressioyyhtalön suorittamiseen kilytettiin vähiten neliömenetelmuki. Kaltevuden, Sieppaksen Ja Korrelaatiookertoimen SuhteelliseNet StandardpoKKeama (RSD) -Arvot Saatiin (Alle 1.4%) Todistateena Hyvistys Lineaarisesta Suhteesta Tällä Alueella. Regressioyhtalöt olivat y = 0.912x –10.29 (R2 = 0.998) Ja Y = 0.941x – 11.77 (R2 = 0.999) Vastavaasti (R) – Ja (S) -Orc: N Diastereomeereille (Tauluko 2) (Tauluko 2).
TarKkuus, TarKkuus Ja Havaitsemisraja
PänivänVäliset (5 pänivaa) ja päovan sisäiset märitystuttkimukset suoritettiin diastereomeeristen seosten neljänset standardiluouksen (20, 40, 60, 100 ng ml-1) TOISTANALYYSILLE (N = 3). Kunkin diastereomeerin palautus ja keskimänärssi sd (Keskihajonta) Laskettiin Ensimmusen Ja Toisen Eluavan Diastereomeerin Piikkien pinta -aloilla Kalibrointalueiden Kaltevudesta JA SIEPPAUUSESTA. Nää on Esitetty Taulukossa 2. Vastanavasti [(S) -L] -Diastereomeerit Olivat Suhteellisen StandardIpoKKeaman Arvot.52% – 1.21% JA 0.58% – 1.20% pänivan sisäisesta -TarKkuudesta JA 0.64% – 1.11% JA 0.67% – 1.17% pänittanen Tarkerkuuden Vuoksi. [(R) -l] -ja [(s) -l] -diastereomeerit Olivat 99.81% – 101.15% JA 99.35% – 101.12% pänivan sisäisesta määhtysesta ja 99.83% – 101.23% JA 98.70% – 101.16% Pääjenssä Tapahtuvasa määhtyKsessä, Vastavasti. Havaitsemisrajan (LOD), Joka Vastaa Signaali-Kohinasuhdetta 3, Havaittiin oleevan 20 Pg ML-1 JA 22 PG ML-1 [(R) -L] -JA [(S) -L] -Lehdelle. -TiosoSastereomeerien Ja KVantitoinnin Rajan (loq), Joka Vastaa Signaali-KohinasUHDetta 10, Havaittiin oleevan 60 PG ML-1 JA 66 PG ML-1 [(R) -L] -JA [(S) -L] -diatereomerit Tauluko 2.
Johtopäytös
Vahvan Elektronin läsnäolo, joka vetyyy Kahden -no2 -ryhmiyn dfdnb -alustalla, helpottaa sen f -aToomin nukleofiilistla substituiota kiraalisen aminohapon amino -ryhmäähde. Kun Taas Kiraalisten apulaitteiden yksinänänien Elektroniparin resonansi dfdnb-Alustan-NO2-Rehmien Kanssa Johti Cdr: N, Fdnp-l-phe: n suureen molaarise absorptioon. Siten niin Saatu cdr pystyy havatsemaan pitoisuutena, ettase läeteolleudelle määrssi 1%: n raja. Todistettu, Ettan Tulokset Ovat Parempia resoluutiolla verrattuna tiettyihin Muihin CSP: IIN, CDR: Iin Ja Cir: Hen, Jotka Ilmoivuttu Kirjallisuudessa. MW -SäteilytyKsessä Daistereomeerit, Jotka syntetisoitiin Lyhyemääki roktioaajalla Verrattuna Muiden Kirjallisuudessa ILMOITTUJEN CDR: IEN JA REAKTIO -OLOSUHTEITUNEJEN.
Tunnustus
Kirjailijat ovat Kitollisia dst Rajasthanille H: n Valitsemisesta.N. Päätutkijaksi Ja Muulle Talodelliselle Tueksi Kirjottajille. Kiitos Jaipurin Suresh Gyan Viharin YlioPistolle Instrumenttinten Ja Muiden Tilojen Tarjoamisesta.
Viitteet
Amini a., OA. Paulsen-Sörman ja d. Westerlund. 2000. Kiraalisten Erootdusten Riippuvuus Syklodekstriinien Määrsätka valitsijoina KäyttaMällä Osittaista TäytTötekniikka kapillaarivyryhykkeen Elektroforeesissa. Chromatographia 51: 226–230.
Ariëns, E. J – -. 1984. Stereomia, Perusta Hienosneneelle Hölpölylle Farmakokineikassa Ja Klinisessä FarmaKologiaassa. Euro. J – -. Klinikka. Farmakoli. 26: 663–668.
Bhushan, r., Ja h. Brückner. 2004. Marfeyn Kiraalisen Aminohappoanalyysin Reagenssi: Katsaus. Aminohapot 27: 231–247.
Bhushan, r., Ja h. Brückner. 2011. Marfeyn Reagenssin ja Analogien KäytTö Kiraaliseen Aminohappoanalyysiin: Arviointi Ja Sovellukset LuonnonTotteSiin ja Biologisiin Järjestelmiin. J – -. Kromatogrammi. B 879: 3148–3161.
Bhushan, r., Ja r. Kumar. 2009a. A-amino-isloholien diastereomeerien Ja Marfeyn Reagenssin, Sen Kiraalisten Varianttien Ja Diastereomeerien, Kiraalisten Varianttien Ja Diastereomerien Diastereomeerien JA Mikroaaltouunin Diastereomeerien Korkean SuoritkyNyn Nestekroomagrafin. J – -. Kromatogrammi. A 1216: 2592–2596.
Bhushan, r., Ja r. Kumar. 2009b. Monikomponenttisen Seoksen Ja Proteinogeenisten ja ei-proteioresoluution Analysi Käänteisen Faasin Korkean Suoritusvyn nesekromatografialla Käytinä. Anaali. Bioaali-. Kemia. 394: 1697–1705.
Bhushan, r., H. Nagar Ja J. Marssit. 2015. Enantiomeerien ratkoiseminen sekä akriaalisten ettat Kiraalisten faasien Kanssa Kromatografiasa: Kästeellinen Haaste. RSC ADV. 5: 28316-28323.
Bhushan, r., Ja h. Nagar. 2013. Proteinogeenhen Aminohappojen Epäsuora enantiopiepaatio Käyttammasa naprokoseenipohjaista Kiraalista Johdannaista Reagensia Ja Hplc: TÄ: TÄ: TÄ. Läähketeteellinen. Kromatogrammi., 27, 750-756.
Bhushan, r., Ja h. Nagar. 2014a. Selenometioniinin Epäsuora EnantiopieTointi Kärtekromatografialla Korkean Suorituskyn äpskettain SynteTiitUa Kiraalista Johdana -reagenssia, JOKA PERUSUU (S)y. Läähketeteellinen. Kromatogrammi., 28, 106-111.
Bhushan, r., Ja h. Nagar. 2014b. Orciprenaliinin, Betaksololin Ja Propranololin enantiospation Käyttomusä Hplc: Tä Ja Uusia Kiraalisia-. Anaali. Letti. 47: 202–219.
Bhushan, r., Ja h. Nagar. 2015. (±) -Isoksiriinien enantiomeerien resoluutio Ja Eristamus Käyttammaä Ohutta Kerrosta SilikageLikerroksia, Jotka Kyllästetty L -glutamiiniHapolla JA SEN DIASTASTEREEREEN EROTTELUNUNESENESENESENESENESENESTENE JOHDANUSENE JOHDANUSENE JOHDANUSENE JOHDANUSENE JOHDANUNE JOHDANUSENE JOHDANUNE JOHDANUNE JOHDANUNE JOHDANUNE JOHDANUSENE JOHDANUSENE JOHDANUN JOHDANUSENE JOHDANUSENE JOHDANUSENE JOHDANUSTEN. Läähketeteellinen. Kromatogrammi., 29, 357-365.
Bhushan, r., JA S. Dixit. 2012. Viiden β-Salpaajan enantoresoluutio Kärtekromatografialla leytttomus viisitoista Kiraalista Johdannaista Reagenss, Joissa Apula -syanAalista KiraalSen KIRAALISHA-APAALAAALIA KIRAAALIA KIRAAALIA KIRAAALIA KIRAAALIA KIRAAALISEA. Läähketeteellinen. Kromatogrammi. 26: 239–246.
Bhushan, r., JA S. Taudi. 2009. Kuuden P-Salpaajan Korkean Suoritutusvyn Nestekromatografinen ENANTIORESOLUUTIO KäyttaMällä DinitrofenyyliLi-l-pro-n-hydroksisukinimidesteria, n-succinimidyyli- (s) -2- (6-metokiat -jahgianaa-langanina-kalunattiat-langanina. Läähketeteellinen. Kromatogrammi. 23: 1291–1299.
Bhushan, r., V. Kumar JA S. Taudi. 2009. Ei-proteiinia-aminohappojen enantiomeerien Kromatografinen Erotaminen Johdettamisen Jälkeen Marfeyn Reagensilla Ja Sen Neljällä VariantillaLa. Aminohapot 36: 571–579.
B ‘hymer c., M. Montes-Bayon Ja J. Eräs. Karuso. 2003. Marfeyn Reagensi: 1-Fluoro-2,4-dinitrofenyyli-5-l-alaniini-amidiini mennneisys, nykyisyys ja Tulevaisuuden Käyttö. J – -. Sekoittaa. Sci. 26: 7–19.
Fujii k., Y. Ikai, t. Mayumi, h. Oka, m. Suzuki Ja K. Harada. 1997. Ei Empiirinen MenetelMä, Joka Käyttatka LC/MS: Tä Aineosien Aminohappojen absoluuttisen Konfiguraation Määrittamiseki peptidissä: Marfeyn MenetelMäyn YHDISTELMÄ MASSASPEKTROMETRIAN JA SEN KONUNYNESENSONSE SOVELSEEN. Anaali. Kemia. 69: 3346–335.
Ich. ICH -Apic Q2A: Analyytttun MenetteLyjen Vimitifointi. Kansainvalinen Konferensi Lääkemen rekisterööniä Koskevan Teknisen Vaatimuksen YHdenmukaistamisesta ihmisen Käytttön: Geneve, 1996.
Lee, E. J – -., Ja K. M. William. 1990. Kiraali: Kliinisiat FarmakoKineettiset Ja FarmakodynaamiseN Näharkoohdat. Klinikka. Farmakokinet. 18: 339–345.
Marfey, P. 1984. D-Aminohappojen MäärittaMinen. II. BifunktionAalisen Reagenssiin, 1,5-difluoro-2,4-dinitrobentseenin Käyttö. Carlsberg. Päättäväisyys. Kommunikointi. 49: 591–596.
Nagar, h. Ja r. Bhushan. 2014. DL-SELENOMETIONININ ENANTIORESOLUUTIO: Ohuilla SilikageLilevyillä, Jotka KylläsStent (-)-Kiniinillä Ja Rptlc: llä Ja Hplc-Erotiksella diastereereillä. Anaali. Menetelmat, 6, 4188–4198.
Ngim, k. K -k -., Q – -. Zhong, k. Ja n n. Chetwyn. 2012. Sulfobutylieetterin p-syklodekstriinimodifikaattorin vaikutus Kärnteisen faasin HPLC-EROTUSTEN SELEKTIIVISYTEEN. J – -. Asua. Kromatogrammi. Rel. Tekniikka. 35: 2845–2859.
Yang, G. S., D -d. M. Chen, y. Yang, b. Tang, J. J – -. Gao, h. Y. Aboul-eenein ja b. Koppenhoefer. 2005. Joidenkin Klinisesti Käyttytenjen Lääkkkeiden enantiopatecation capillaarielektroforeesilla ken Käytttolallä sulfatoitua p-Syklodekstriini Kiraalisen Valitsimena. Chromatographia 62: 441–445.
Zahn, h., Ja J. Meienhofer. 1958. Reaktionden von 1,5-difluor-2,4-dinitrobentsoyyli Mit-Insuliini. Mino. Synthese von modellverbindungen. Makromoli. Kemia. Fyysinen. 26: 126–152.
pöyta 1 KirjallisUusraportit, Joissa Nykyinen Tuttkimus Orc: N Enantiomeerien Kromatografisesta EroTutsesta (RS) Käyttamusi Erilaisia CSPSA/CDRSB/CIRC: TÄ Käytthämää
| S. ei. | CSPSA/CDRSB/CIRC | Rs | Viive |
| 1 | Metyyli-P-Syklodekstrina | 3.95 | Amini et ai. (2000) |
| 2 | Sulfobutylieetteri β-Syklodekstriini | 0 – -.80 | Ngim et ai. (2012) |
| 3 | Selluloosa-tris (3,5-dimetyyylifeniyyliikarbamatti) a | 4.68 | Ullrich et ai. (2001) |
| 4 | Sulfated-β-Syklodekstrina | 2.03 | Yang et ai. (2005) |
| 5 | (R) -2- (5-fluori-2,4-dinitrofenyyliamino) -3- (metyylitio) propanoiinihappob | 9.79 | Bhushan Ja Nagar (2014b) |
| 6 | (S) -N- (1-Sykloheksyylietylietylity) -5-fluori-2,4-dinitrobenzenamineb | 10.22 | Bhushan Ja Nagar (2014b) |
| 7 | (R) -5-fluori-2,4-dinitro-n- (1-fenyylietylitylity) Bentsenamineb | 8.26 | Bhushan Ja Nagar (2014b) |
| 8 | L-glutamiinihappo | 2.10 | Bhushan et ai. (2015) |
Tauluko 2 YHTEENVETO HPLC -MenetelMäinä invoroinnnista, Joka Sisälttiä Lineaarisuutta, Ja Väliaikaisia TarKKuuksia Ja PalauTumisttutKIMuksia
| Ensimäinen eluing -diastereomeeri | Toinen Eluing -diastereomeeri | ||||||||||
| Lineaarisuus | |||||||||||
| Etaaisyys | 20–100 ng ml-1 | 20-100 ng ml-1 | |||||||||
| Rinne | 0 – -.912 | 0 – -.941 | |||||||||
| Siomat | -10.29 | –11.77 | |||||||||
| KorrelaatioSokerroin (R2) | 0 – -.998 | 0 – -.999 | |||||||||
| Todellinen Keskitymeen
ng ml-1 |
Keskiarvo ± SD (mitattu)
ng ml-1 |
Elpymiini (%) | RSD (%) | Keskiarvo ± SD (mitattu)
ng ml-1 |
Elpymiini (%) | RSD (%) | |||||
| Pänivan sisainen tarturkuus (n = 3) | |||||||||||
| 20 | 10.109 ± 0.122 | 99.93 | 1.21 | 10.116 ± 0.131 | 99.97 | 1.20 | |||||
| 40 | 19.843 ± 0.175 | 101.105 | 0 – -.88 | 19.789 ± 0.162 | 101.12 | 0 – -.82 | |||||
| 60 60 60 | 30.116 ± 0.174 | 99.81 | 0 – -.58 | 30.215 ± 0.195 | 99.35 | 0 – -.65 | |||||
| 100 | 49.450 ± 0.255 | 101.05 | 0 – -.52 | 49.612 ± 0.288 | 101.08 | 0 – -.58 | |||||
| PäniNVälinen tarturkuus (n = 3) | |||||||||||
| 20 | 9.929 ± 0.110 | 100.05 | 1.11 | 10.168 ± 0.118 | 101.16 | 1.17 | |||||
| 40 | 19.956 ± 0.196 | 99.89 | 0 – -.98 | 19.923 ± 0.189 | 99.96 | 0 – -.95 | |||||
| 60 60 60 | 30.158 ± 0.236 | 99.83 | 0 – -.75 | 30.105 ± 0.217 | 100.09 | 0 – -.72 | |||||
| 100 | 50.853 ± 0.325 | 101.23 | 0 – -.64 | 49.790 ± 0.334 | 98.70 | 0 – -.67 | |||||
| Herkkyys | |||||||||||
| Havaitsemisraja (PG ML-1) | 20 | 22 | |||||||||
| KVANTIFIOINTIRAJA (PG ML-1) | 60 60 60 | 66 | |||||||||
Kuvio KuvateksteJä
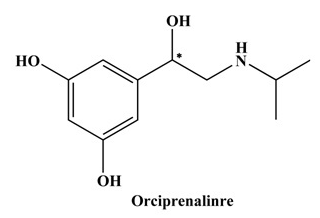
Kuva. 1 Orkiprenaliinin rakenette (* Edustaa Kiraalista Keskustaa).
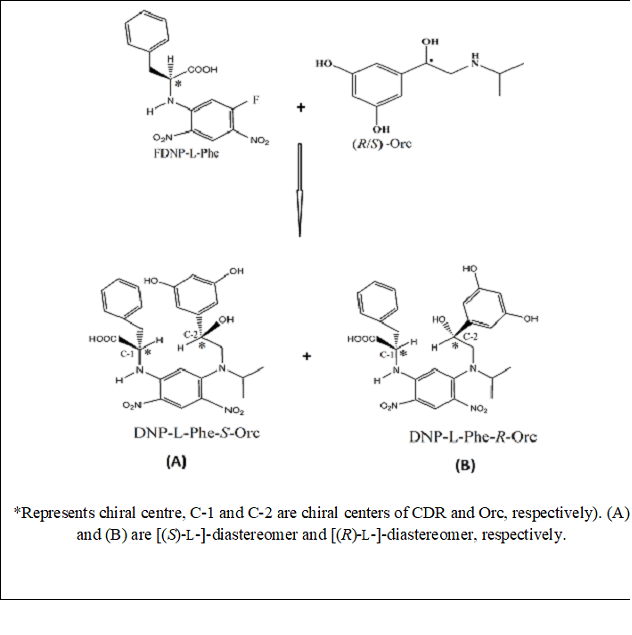
Kuva.2 Kaavio (r/s) -orc: n daistereomeerien Synteesille CDR: llä (fdnp-l-phe)
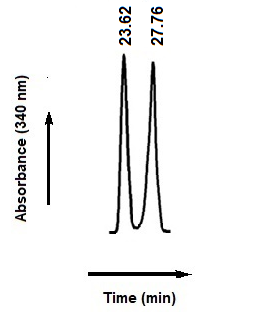
Kuva. 3 CDR: llä ValmisteTujen Orc: N Diastereomeerien Resoluution Kromatogramm (FDNP-l-phe).
Kromatografiset Olosuhteet: Promosil C18 (250 × 4.6 mm I.d -d., 5 µm Hiukkaskoko); MOBIili VaiHe 2, Lineaarinen Gradientti (30 – 65%) MECN: STÄ 0: LLA.10% TFA ORC: N Diastereomeereille 45 MINUUTissa; fl ow -Nopeus, 1.0ml/min; Havaitseminen, 340 nm. Vasemmalta oikealle, Ensimmusinen Ja Toinen Piikki ovat Vastanavasti [(r) -l] -ja [(s) -l] -diatereomeerit.
Kuva. 4 Kohdassa [(S) -L] -Diastereomeeri, HydrofobISet Ryhmät, -CH2C6H5 CDR: N (C -1) JA -C6H3 (OH) 2 STEREOGEGEENISESSÄKUKUKSESSA ORC: N (C -2) STEEREOGEENISESTAKE KESKUKUSESA (C -2) PUOLI SUHTEESSA DINITROBENTESEENIOSAN TASOON JA SITEN KASI RYHMÄU SUUNNATTU CIS-TYYPPISEEN Järjeslyyn (Viikuna. 4a). .4b).


